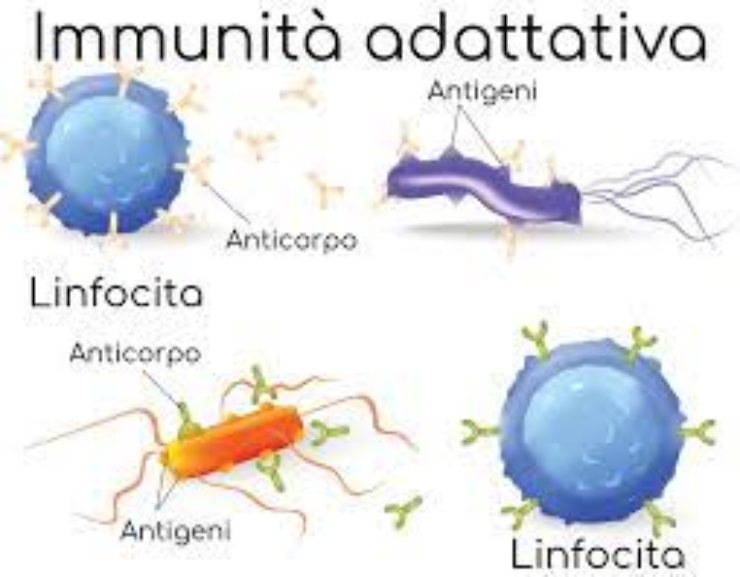
Tra gli attori del nostro sofisticato sistema immunitario troviamo i linfociti NK. Rappresentano la popolazione di globuli bianchi in grado di determinare una risposta contro specifiche minacce.
Complessivamente, il pool di linfociti dell’organismo permette di riconoscere virtualmente tutti gli antigeni possibili e determinare una risposta adeguata.
Linfociti NK (Natural killer cells)
I NK sono linfociti granulari con funzione effettrice coinvolti nei primi stadi della risposta immunitaria innata. Esercitano la loro azione citotossica distruggendo cellule infette (principalmente da virus) o cellule somatiche disfunzionali (tumorali) senza una precedente sollecitazione.
Come gli altri, essi originano dalla linea mieloide nel midollo osseo da cui poi migrano per proseguire il processo di maturazione in altri tessuti.
Utilizzando specifici recettori (NKRs), i NK riconoscono i loro bersagli in base alla presenza di molecole MHC di classe I (o simili) sulla loro superficie.
Dopo il riconoscimento i NK rilasciano citochine (tra cui IFN-γ, TNF-α, IL-10 e GM-CSF) e chemochine, causando la lisi o l’apoptosi delle infette. La loro funzione è pertanto analoga a quella esercitata dai linfociti T-citotossici nell’immunità adattativa.
La reattività delle cellule NK è regolata da un complesso equilibrio tra molecole di attivazione e inibizione localizzate sulla loro superficie, in grado di interagire con specifiche molecole HLA sulle cellule bersaglio.
Potrebbe interessarti>>>Simulazione di shopping: ecco come lo faremo nel 2030
I recettori Killer immunoglobulin-like
Tra questi, i recettori KIR (killer immunoglobulin-like) appartengono alla superfamiglia delle immunoglobuline. I KIR riconoscono in modo specifico gli alleli HLA-A, -B e -C, producendo segnali stimolanti o inibitori a seconda della sequenza del dominio intracellulare. I KIR inibitori e attivanti presentano domini extracellulari molto simili, pertanto legano ligandi identici.
Quando i linfociti NK riconoscono cellule infette o tumorali rilasciano granuli citoplasmatici contenenti citotossine (perforine, granzimi e granulisina) che lisano le cellule bersaglio. La perforina è una piccola proteina in grado di causare la lisi della membrana cellulare. Attraverso i pori formati, i granzimi possono entrare nella cellula bersaglio e la loro attività può innescare la cascata delle caspasi.
Tale processo porta all’apoptosi delle cellule infette (cioè la morte programmata delle cellule).
Le cellule NK rappresentano inoltre un collegamento tra la risposta immunitaria innata e quella adattativa, attraverso interazioni bidirezionali con le cellule dendritiche (DC).
Agli inizi della reazione immunitaria (i.e., antitumorale), dopo l’incontro con cellule tumorali, le cellule DC immature secernono TNF-α e inducono l’attivazione dei NK.
Nell’altro senso, la lisi di bersagli tumorali ad opera di NK rilascia detriti cellulari contenenti antigeni, che possono essere internalizzati da DC mature per poi essere presentati ai linfociti T nei linfonodi.
Cellule NK e cancro: immunoterapia
Data la partecipazione di componenti del sistema immunitario innato alla sorveglianza tumorale, studi clinici utilizzano linfociti NK per il trattamento di pazienti affetti da tumore. Tali terapie consistono nell’uso di cellule NK attivate, o infusioni in vivo di citochine mirate all’espansione e all’attivazione dei linfociti NK contro cellule tumorali.
Tali strategie immunoterapeutiche, che inducono e modulano la risposta immunitaria innata e adattiva, possono rivelarsi estremamente utili nel progresso verso un’immunità antitumorale.
Potrebbe interessarti>>>Starlink di Elon Musk: internet dove vuoi, ma come funziona?
Linfociti NK e Sars-COV-2
Dati i diversi approfondimenti sul ruolo protettivo dei linfociti NK verso le infezioni virali, è stato valutato l’effetto da parte di queste popolazioni cellulari sul virus Sars-Cov-2. I dati da loro raccolti possono far luce su come le cellule NK emergano rispetto alle altre popolazioni cellulari nei pazienti affetti da COVID-19.
Molto recentemente, è stato dimostrato che si ha una forte risposta da linfociti T CD4+ e CD8+ prelevati da pazienti con COVID-19, rispetto a pazienti non esposti al virus.
In particolare, i T CD4+ sono attivati quando i PBMC sono esposti a epitopi della proteina spike (S). Le cellule CD8+ sono attivate, invece, da epitopi derivati da M ed S, con almeno altre otto cornici di lettura aperte.
Inoltre, i pazienti con COVID-19 producono anticorpi anti-S a livelli corrispondenti all’ampiezza dell’attivazione dei linfociti T CD4+ specifici per S, e anche le risposte dei linfociti T CD4+ e CD8+ sono ben correlate. Questa osservazione conferma il ruolo dei linfociti T CD4+ nell’aiutare i linfociti B a produrre anticorpi e a orchestrare una risposta T CD8+.
Potrebbe interessarti>>>In quanti possono compiere gli anni lo stesso giorno? Il paradosso del compleanno
Linfociti NK e malattie
Rivestendo ruoli importanti nella risposta immunitaria, alterazioni genetiche o acquisite della funzionalità dei linfociti NK possono causare malattie di natura molto grave.
Tra queste:
- perdita di protezione contro virus e batteri:una delle più gravi è l’immunodeficienza combinata grave (SCID), causata da mutazioni in diversi geni (IL2RG, JAK3, ADA, IKZF1).
- Malattie autoimmuni come: la sclerosi multipla (SLA), artrite reumatoide (RA) e lupus eritematoso sistemico (SLE).